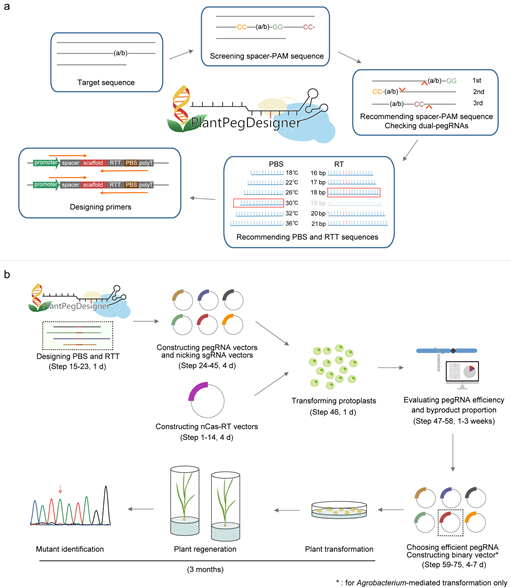
基于CRISPR系统开发出的引导编辑系统(Prime Editing, PE)能够在基因组的靶位点处实现精准的片段插入、删除及碱基的任意替换,在基因治疗、育种改良、基础研究等方面展现出了巨大的应用前景。中国科学院遗传与发育生物学研究所高彩霞研究组前期在水稻、小麦中建立并优化了植物引导编辑系统,实现了任意碱基精准的替换、增添或删除。然而在应用过程中,研究组也发现该系统依然存在效率偏低、设计复杂等问题,难以满足育种需要及在不同基础研究场景下的需求(Lin et al., Nature Biotechnology, 2020)。对此,研究组通过对PE系统进行多轮升级改造,成功开发了“Tm值指导PBS序列设计”、“双pegRNA策略”及“逆转录酶的工程化改造”三种优化策略,将引导编辑系统效率平均提升了10倍以上,并开发了在线的高效、自动化引导编辑实验设计网站PlantPegDesigner(Lin et al., Nature Biotechnology, 2021; Zong et al., Nature Biotechnology, 2022)。
为了进一步推进引导编辑的应用,高彩霞研究组应邀在Nature Protocols杂志发表文章,详细介绍了如何克服引导编辑设计复杂的问题。该论文首先描述了高效pegRNA的设计方法:前期研究发现植物细胞中pegRNA的编辑效率与PBS序列的Tm值(melting temperature,Tm)有关,在水稻中PBS序列Tm值为30℃的pegRNA能够获得最大的编辑效率;使用双pegRNA策略,即针对所需突变同时向细胞中递送分别靶向DNA两条链的两个pegRNA进行共同编辑,可以进一步大幅度提升植物引导编辑的编辑效率。接下来,作者详细描述了在线自动化pegRNA设计网站PlantPegDesigner的使用流程,该网站能够兼顾上述两种策略,提供完整的pegRNA选择、设计与推荐方案,方便使用者快速设计高活性pegRNA。进一步地,该论文对如何使用能够稳定提高编辑效率的ePPE引导编辑器进行了详细描述。相比于传统版本的引导编辑器,ePPE在碱基替换、小片段插入、删除以及较大片段的插入和删除等多种编辑类型下的编辑效率显著提升,且不增加副产物及脱靶效应。接下来,本论文对载体组合的使用、基于原生质体的编辑效率检测、引导编辑系统的植物细胞荧光报告系统的使用和引导编辑实验结果的二代测序数据分析等流程进行了详细描述。使用该文章描述的实验方法,可以在2~3周内完成引导编辑的原生质体实验,最快在3个月内获得经过引导编辑的再生水稻植株。此外,该方法可以便捷地推广到其他物种中,并随着新型引导编辑工具的不断优化而得到更广泛的应用。
三位审稿人均对该文章给予了高度评价:“作者全面、系统地介绍了如何在作物中实现高效的基因组编辑,以流畅、易读的方式总结了引导编辑的实验方法”;“该论文逻辑清晰,对想在水稻或其他植物物种中进行引导编辑的研究人员非常有用”;“这是一篇想对水稻、小麦或玉米进行引导编辑的科研人员的非常好的实验指南”。
该文章于2020年11月25日在线发表于Nature Protocols杂志(DOI:10.1038/s41596-022-00773-9)。高彩霞研究组博士后靳帅、林秋鹏为该论文的第一作者,高彩霞研究员为通讯作者。北京齐禾生科生物科技有限公司的高强博士参与了此项工作。该研究得到农业部、中国科学院战略性先导专项A、中国科学技术协会青年人才托举工程、博士后创新人才支持计划等项目的经费资助。
图:高效植物引导编辑实验流程。(a) 高效、自动化的pegRNA 设计方法 (b) 引导编辑实验设计与植物突变体获得。