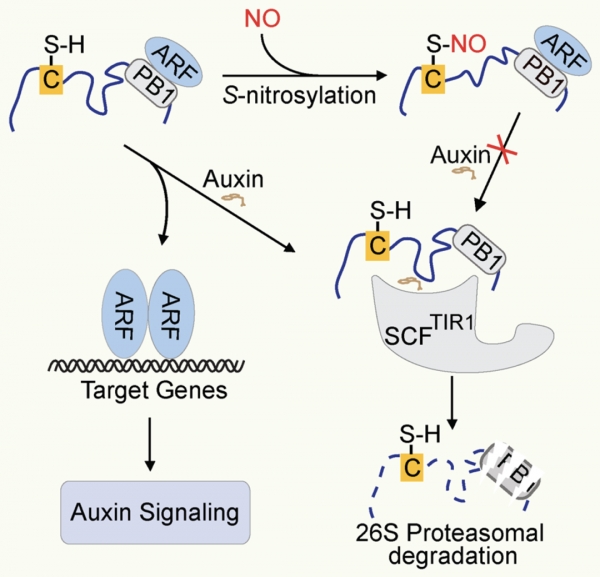
为探索NO是否直接影响生长素信号转导抑制子蛋白IAA17的生物学功能,该研究首先检测了NO供体SNP和GSNO对IAA17NT-GUS融合蛋白稳定性的影响,发现NO可以抑制IAA17NT-GUS蛋白的降解。进一步发现IAA17NT-GUS蛋白在NO浓度升高的突变体中也显著积累。生物化学实验结果表明IAA17蛋白的S-亚硝基化修饰发生在Cys-15和Cys-70位点。分子模拟发现IAA17蛋白的Cys-70位点与生长素受体TIR1之间的互作频率远高于Cys-15位点,暗示Cys-70在IAA17和TIR1之间的相互作用中发挥重要作用。人工合成的酵母Aux/IAA蛋白降解实验表明,模拟亚硝基化修饰的IAA17C70W点突变蛋白的降解在该酵母体系中显著受到抑制。免疫共沉淀和蛋白降解实验发现NO供体GSNO明显抑制IAA17蛋白和受体TIR1的结合。IAA17C70W点突变转基因植物表现出对生长素拮抗和侧根缺失的表型。
Nitric oxide (NO)调控生长素信号转导的分子机制
生长素抑制子蛋白IAA17在Cys-70位点的S-亚硝基化修饰可能改变IAA17蛋白的空间状态,从而削弱其与受体TIR1的结合,导致IAA17蛋白积累进而抑制生长素信号转导
作者简介
中国科学院遗传与发育生物学研究所已毕业博士生景宏伟和杨晓璐为该论文共同第一作者,景宏伟博士和左建儒研究员为共同通讯作者。相关工作得到国家自然科学基金、中国科学院和植物基因组学国家重点实验室资助
引用本文
Hongwei Jing, Xiaolu Yang, Ryan J. Emenecker, Jian Feng, Jian Zhang, Marcelo Rodrigues Alves de Figueiredo, Patarasuda Chaisupa, R. Clay Wright, Alex S. Holehouse, Lucia C. Strader, Jianru Zuo. (2023). Nitric oxide-mediated S-nitrosylation of IAA17 protein in intrinsically disordered region represses auxin signaling. Journal of Genetics and Genomics.
DOI:10.1016/j.jgg.2023.05.001