喹诺酮介导的代谢交叉喂养增强酸性土壤微生物功能菌群铝耐受性的机制
Quinolone-mediated metabolic cross-feeding develops aluminium tolerance in soil microbial consortia

Article,2024年11月22日,Nature Communications,[IF=14.7]
DOI:https://doi.org/10.1038/s41467-024-54616-0
第一作者:Zhiyuan Ma(马志远)、Meitong Jiang(姜美彤)
通讯作者:Yuting Liang(梁玉婷)
合作作者:刘朝阳、王二涛、白洋、袁梦婷、施盛静、周集中、丁骥贤、谢亦梅、张慧、杨艳、沈仁芳、Thomas W. Crowther、张佳宝
主要单位:
中国科学院南京土壤研究所(State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing, China)
- 摘要 -
具有铝(Al)耐受性的有益细菌能够增强作物在广泛分布的酸性土壤中抵御铝毒性的能力。然而,微生物共生体在酸铝毒胁迫下如何保持铝耐受性的具体机制尚不清楚。本研究显示,由红城红球菌(Rhodococcus erythropolis)和铜绿假单胞菌(Pseudomonas aeruginosa)组成的土壤细菌功能菌群的铝耐受性优于其单独成员。铜绿假单胞菌会释放一种群体感应分子——2-庚基-4-喹诺酮(2-heptyl-1H-quinolin-4-one,HHQ),该分子可被红城红球菌高效降解。这一降解过程降低了铜绿假单胞菌种群密度生长限制,进一步增强了其在铝胁迫下的代谢活性。此外,红城红球菌能够将HHQ生物转化为色氨酸,促进自身肽聚糖的合成,增强了细胞壁的稳定性,进而提升了红城红球菌的铝耐受性。本研究揭示了一种基于交叉喂养过程维持微生物铝耐受性的机制,为设计合成微生物菌群以支持酸性土壤地区的粮食安全和可持续农业提供了新的见解。
- 引言 -
物种间的相互作用是推动微生物群落活动的主要动力,对群落的组成、结构和功能具有重要影响。在自然栖息地中,微生物群落通常通过代谢交叉喂养机制获取必需的营养物质并维持生物多样性。微生物生产者合成一系列物质,包括胞外酶和重要的代谢产物(如糖、有机酸和氨基酸),可以被邻近的微生物利用。微生物通过复杂的相互作用产生了一种“整体大于部分之和”的效果,即这种相互作用产生的协同效应让整个群落的功能表现优于各个微生物单独作用的简单相加。这些微生物相互作用的核心是群体感应(QS),这是一种能够调节营养物质摄取和代谢过程的机制,从而塑造微生物对动态环境的响应。在存在多重障碍因子的土壤环境中,微生物间通过这种策略,从个体到群落层面保持功能和生物多样性。因此,非竞争性代谢产物池对于促进有益的代谢相互作用具有优势。例如,枯草芽孢杆菌和德尔夫特氏菌通过丙酮酸交换建立互利关系,以维持在土壤中的生存和竞争优势,同时调节土壤中砷循环。
铝(Al)毒性是酸性土壤中的主要胁迫因素,被认为是全球作物继干旱之后的第二大非生物胁迫。当pH值降至5.5以下时,大量Al3+会释放到土壤溶液中,可能导致微生物细胞壁松弛、膜破裂以及细胞成分泄漏,从而阻碍微生物活性,严重时甚至导致细胞死亡。耐铝微生物通过多种机制来应对铝毒性,例如加强细胞壁强度和分泌有机酸以螯合Al3+。除了个体的耐受能力和生存机制外,微生物之间的多样化相互作用使其在环境胁迫下能够维持群落活动、多样性和稳定性。这或许能够解释为何酸性土壤中分布着具有不同铝耐受性的微生物群体。我们之前的研究已表明,基于自然微生物群落构建的合成微生物菌群比单一微生物具有更好的表现。然而,这些微生物在铝毒性胁迫下如何共存和耐受的机制仍存在显著的知识空白。
在之前的研究中,我们在酸性土壤中建立了一个合成微生物群落(synthetic microbial community,SynCom),由两种细菌菌株——红城红球菌(Rhodococcus erythropolis)和铜绿假单胞菌(Pseudomonas aeruginosa)组成,具有不同的铝耐受性水平。值得注意的是,SynCom在田间表现出强大的共定殖能力,并且在促进植物生长方面优于单一菌株。因此,我们推测,SynCom的成员可以通过交叉喂养机制来增强群落层面的铝耐受性并促进植物生长。
在本研究中,我们发现,SynCom的铝耐受性优于单独的红城红球菌或铜绿假单胞菌。铜绿假单胞菌会产生次生代谢产物HHQ,该物质被红城红球菌高效降解。此降解过程减少了铜绿假单胞菌群体生长的限制,增强了铜绿假单胞菌在铝胁迫下的代谢活性。此外,红城红球菌通过分支酸合成途径将HHQ转化为色氨酸,促进肽聚糖的合成,从而提高细胞壁的稳定性和铝耐受性。本研究揭示了物种间铝耐受性的机制,这对于增强微生物群落功能,并为可持续农业应用中的SynCom设计和开发提供了宝贵的理论依据。
- 主要结果 -
合成微生物菌群(SynCom) 增强了单菌株的效果
在盆栽和田间条件下,由铝耐受的红城红球菌(Rhodococcus erythropolis,Rh)和铜绿假单胞菌(Pseudomonas aeruginosa,Ps)组成的合成微生物群落(SynCom)在酸性铝毒性环境下显著提高了水稻的生物量和产量,表现优于单一菌株接种或未接种处理(CK)。此外,根部铝含量在SynCom接种下最低,其次是铜绿假单胞菌(Ps)、红城红球菌(Rh)和未接种(CK)处理。
在盆栽实验中,通过定量实时聚合酶链式反应(qRT-PCR)发现,与单菌株接种相比,SynCom菌株显示出更高的定殖丰度和稳定的定殖效率(图1a和b)。利用荧光原位杂交(FISH)观察到,单一接种铜绿假单胞菌(Ps)抑制了土壤中红城红球菌的生物量,而共接种则增加了红城红球菌的生物量(图1c)。
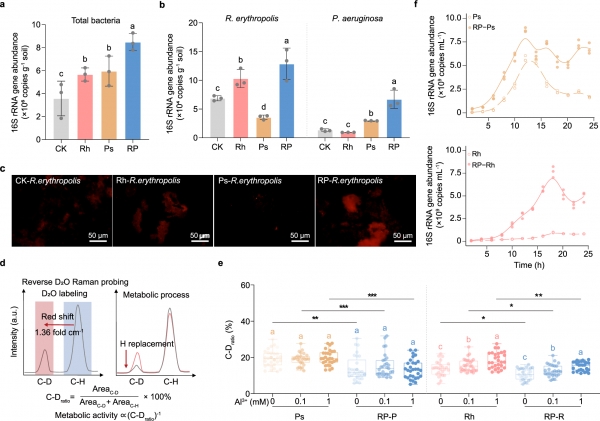
图1 单菌培养与共培养条件下红城红球菌(Rh)和铜绿假单胞菌(Ps)群落密度和活性的变化。
a-b. 水稻根际土壤中总细菌(a)、红城红球菌和铜绿假单胞菌(b)的绝对丰度(n=3)。
c. 红城红球菌在根际土壤中的荧光原位杂交结果,比例尺为50 μm。荧光实验独立重复三次。
d. 单细胞反向重水标记原理和代谢活性计算公式(C-Dratio)。AreaC-D表示重水替代后2,040-2,300 cm-1范围内拉曼峰的积分面积(C-D),AreaC-H表示未被替代的C-H在2,800-3,100 cm-1的积分面积。
e. 单菌培养与共培养条件下不同Al3+浓度(pH 4.0)下红城红球菌和铜绿假单胞菌的代谢活性(n=30个单细胞)。
f. 单菌培养与共培养处理下铜绿假单胞菌和红城红球菌的绝对丰度随时间的变化(n=3)。
在图(e)中,CK:未接种;Rh:接种红城红球菌;Ps:接种铜绿假单胞菌;RP:接种红城红球菌和铜绿假单胞菌;RP-R:共培养中的红城红球菌;RP-P:共培养中的铜绿假单胞菌。
在单细胞拉曼光谱结合重水标记(反向拉曼-D2O)实验中,C-D比率较低的细胞表明在铝胁迫下代谢活性更强(图1d)。研究表明,在pH 4.0的最小培养基中,这两种细菌对铝胁迫的耐受性不同。无论单独培养或共培养,铜绿假单胞菌的代谢活性在不同Al3+浓度下保持不变。与单独培养相比,红城红球菌在与铜绿假单胞菌共培养下代谢活性显著增强(图1e)。相比之下,当Al3+浓度从0 mM增加到1.0 mM时,单菌培养中红城红球菌的代谢活性下降了13.49%至28.46%,而共培养中红城红球菌的代谢活性增加了18.76%至25.42%。此外,共培养显著提高了酸性铝胁迫下的溶磷效率。
随后,我们比较了在0.1 mM Al3+(pH 4.0)条件下共培养的两种细菌的生长曲线(图1f)结果表明,共培养显著增强了红城红球菌的铝耐受性,同时缓解了铜绿假单胞菌的密度依赖性生长限制。
这些发现表明,这两种细菌在共存过程中形成了互惠关系。具体而言,共培养显著增强了红城红球菌的铝耐受性,同时缓解了铜绿假单胞菌的密度依赖性生长限制。因此,我们推测这两种细菌可能通过代谢产物的共享或交换进行协同代谢相互作用,从而增强它们对铝胁迫的适应能力。
由喹诺酮介导的物种间相互作用
为揭示红城红球菌与铜绿假单胞菌之间交叉喂养的代谢底物,我们在酸性铝胁迫(pH 4.0)条件下分别分析了在单菌培养和共培养条件下的代谢物。通过GC-MS共检测到19种代谢物,包括糖类、长链脂肪酸和芳香族化合物。其中,群体感应信号分子HHQ仅在单菌培养的铜绿假单胞菌中被检测到,而在红城红球菌单菌培养中则不存在。此外,与单菌培养相比,共培养中的HHQ浓度减少了约一半(图2a)。
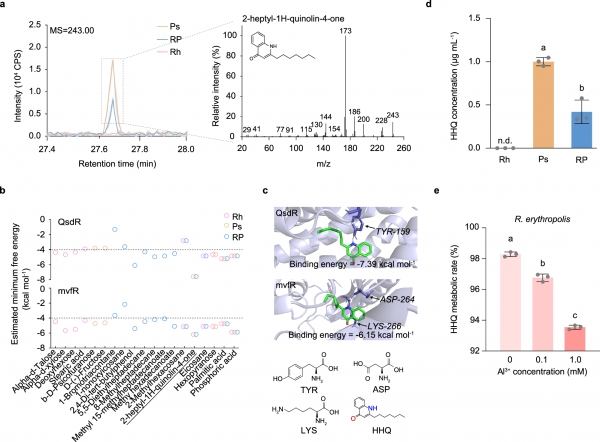
图2 关键代谢物HHQ的鉴定、识别。
a. 在单菌培养和共培养条件下鉴定的HHQ的一、二级质谱图。实线表示平均峰值,阴影区域为标准差(n=3)。
b. 利用柔性对接预测的19种物质与蛋白分子的最低结合自由能,其中虚线(-4)表示配体与受体蛋白结合的自由能阈值。
c. HHQ与蛋白结合时的最低自由能对应的结合位点,标记了酪氨酸(TYR)、天冬氨酸(ASP)和赖氨酸(LYS)。
d. 测定红城红球菌和铜绿假单胞菌在单菌培养和共培养条件下培养基中HHQ的相对浓度。
e. 红城红球菌在不同Al3+浓度(pH 4.0)下经过8小时孵育后对20 μM HHQ的降解率。
Rh:红城红球菌单菌培养;Ps:铜绿假单胞菌单菌培养;RP:红城红球菌与铜绿假单胞菌共培养。
我们进一步利用半柔性分子对接模拟计算各代谢物与红城红球菌的QsdR(群体感应降解调节因子)和铜绿假单胞菌的mvfR(多重毒力因子调节因子)蛋白的最小结合自由能。在所有检测到的物质中,HHQ与QsdR和mvfR的结合自由能最低(分别为-7.39 kcal/mol和-6.15 kcal/mol),表明HHQ更有可能与目标蛋白结合。这种优先结合可能归因于HHQ独特的喹诺酮结构,其电子吸引的苯酚基和电子供体的吡啶基有助于更容易结合到蛋白结合位点(图2b和c)。
随后,我们在纯培养条件下定量并确认了铜绿假单胞菌的HHQ产量及红城红球菌的HHQ降解能力。在0.1 mM Al3+的最小培养基中孵育12小时后,HHQ在红城红球菌单菌培养中未检测到,但在铜绿假单胞菌单菌培养中浓度为1.0 ± 0.05 μg/mL,而在共培养中HHQ浓度显著降至0.42 ± 0.14 μg/mL(图2d)。此外,随着Al3+浓度的增加,单菌培养的红城红球菌在8小过程中显著降解HHQ(图2e)。在自然和灭菌条件下的水稻酸性土壤,以及灭菌黏土基质中进行的实验也证实,红城红球菌在液体培养基和土壤基质中均可高效降解HHQ。
综上所述,我们的研究揭示了共培养系统中两种细菌之间的重要代谢互作过程。铜绿假单胞菌产生的HHQ不仅参与微生物群体的群体感应调节过程,还可被红城红球菌作为资源利用,从而增强其对铝毒性胁迫的耐受能力。
红城红球菌通过降解HHQ促进细胞壁合成
通过转录组分析,我们确定了红城红球菌与铜绿假单胞菌之间的差异表达基因(DEGs)所富集的前10个代谢通路。在单菌培养的铜绿假单胞菌中,铝胁迫条件下的下调DEGs主要涉及鞭毛装配、趋化性和生物膜形成通路。而在与红城红球菌的共培养中,铜绿假单胞菌的下调DEGs主要富集于双组分系统、群体感应和氨基酸代谢等通路。
在红城红球菌中,细胞壁合成和色氨酸代谢通路的表达模式在不同条件下表现出明显差异。在单菌培养下,这些通路在铝胁迫下显著受到抑制;而在共培养中则显著上调。对富集通路的网络分析显示,与色氨酸代谢通路相关的DEGs通过双组分系统通路与肽聚糖合成通路相连,表明色氨酸代谢基因可能促进肽聚糖的合成。
利用扫描电子显微镜(SEM)和原子力显微镜(AFM),我们进一步分析了铝胁迫下红城红球菌的细胞形态和细胞壁特性。铝离子(Al3+)导致的细胞壁损伤在与铜绿假单胞菌共培养或在培养基中添加20 μM HHQ后得到改善,细胞壁上未出现明显的折叠或断裂。随着Al3+浓度从0 mM增加到0.1 mM和1 mM,红城红球菌的细胞壁厚度从8.56 nm减小至4.10 nm和3.34 nm,同时粗糙度也从6.36 nm下降至4.11 nm(图3a)。然而,添加20 μM HHQ可以缓解铝对细胞壁厚度和粗糙度的损害,细胞壁厚度增加至11.20、14.89和19.34 nm,粗糙度增加至8.52 nm(图3b)。对于铜绿假单胞菌,在Al浓度增加的情况下,细胞厚度显著增加,而壁粗糙度保持不变(图3c)。
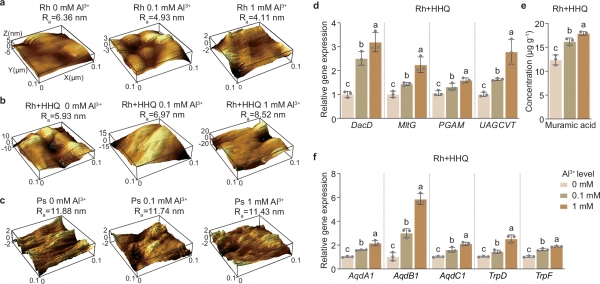
图3 红城红球菌通过代谢HHQ增强细胞壁合成。
a-c. 不同处理下红城红球菌细胞壁厚度及褶皱程度的三维结果。
d. 在不同Al3+浓度(pH 4.0)和20 μM HHQ添加条件下,红城红球菌中与细胞壁酸合成相关基因(DacD、MltG、PGAM和UAGCVT)的相对表达水平分析。
e. 在不同Al3+浓度(pH 4.0)和HHQ添加条件下,红城红球菌细胞壁酸浓度的测量结果。
f. 在不同Al3+浓度(pH 4.0)和20 μM HHQ添加条件下,红城红球菌中烷基喹诺酮特异性分解酶(AqdA1、B1、C1)和色氨酸合成基因(TrpD、TrpF)的相对表达水平分析。
Ra:粗糙度;Rh:红城红球菌单菌培养;Rh+HHQ:添加20 μM HHQ的红城红球菌单菌培养;Ps:铜绿假单胞菌单菌培养。
我们还调研了红城红球菌降解HHQ并合成色氨酸以促进细胞壁相关物质合成的潜在代谢途径。通过qRT-PCR定量分析细胞壁合成和喹诺酮氧化相关基因的表达水平,发现细胞壁合成通路中的关键基因(DacD、MltG、PGAM和UAGCVT)在Al3+梯度中显著下调,但在添加20 μM HHQ时显著上调(图3d)。进一步的定量分析显示,在HHQ存在下,随着Al3+浓度增加,红城红球菌细胞中与细胞壁合成相关的胞壁酸浓度增加(图3e)。此外,HHQ的加入提升了烷基喹诺酮特异性分解酶(AqdA1、B1和C1)及核糖转移酶基因(TrpD和TrpF)的表达水平,将HHQ降解与色氨酸合成联系起来(图3f)。这一代谢在灭菌的黏土基质和酸性土壤系统中均得到了验证。这种代谢关系可能促进了共培养条件下色氨酸的合成,从而有助于细胞壁的形成。
为了进一步明确色氨酸在细胞壁合成和铝胁迫防御机制中的作用,我们分析了与相关通路基因在不同Al3+浓度下的转录水平。结果表明,Al3+暴露显著下调了磷酸葡萄糖胺变位酶(PGAM)和UDP-N-乙酰氨基葡糖1-羧乙烯转移酶(UAGCVT)基因的表达,这些基因对红城红球菌中N-乙酰胞壁酸的生成至关重要(图4a)。外源添加的色氨酸或与铜绿假单胞菌的共培养显著提升了这些基因的表达水平。D-丙氨酰-D-丙氨酸羧肽酶(DacD)和溶菌酶(MltG)基因的转录活性及胞壁酸浓度的变化也显示出一致趋势,表明色氨酸促进了红城红球菌在铝胁迫下的增殖(图4b)。
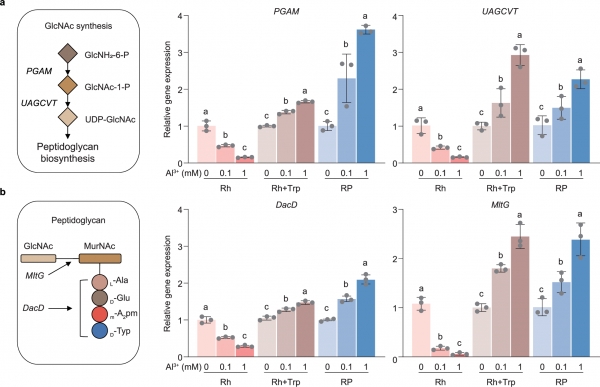
图4 色氨酸介导的肽聚糖合成相关基因在红城红球菌中的转录表达分析。
a. 与N-乙酰氨基葡萄糖(GlcNAc)合成相关的功能基因相对表达水平分析。
b. 与肽聚糖合成相关的功能基因相对表达水平分析。
Rh:红城红球菌单菌培养;Rh+Trp:添加色氨酸的红城红球菌培养;RP:红城红球菌与铜绿假单胞菌共培养。
- 讨论 -
交叉喂养在自然微生物群落中广泛存在。本研究表明,具有不同铝耐受能力的微生物之间的交叉喂养能够增强合成微生物菌群的整体效果。在共培养系统中,铝耐受性较强的铜绿假单胞菌优先占据稳定的生态位,并产生代谢底物HHQ,与红城红球菌形成了单向的交叉喂养关系(图5a)。随后,红城红球菌将HHQ降解为邻氨基苯甲酸(AA),进一步转化为色氨酸。色氨酸在N-乙酰胞壁酸的合成中起到关键作用,最终促进肽聚糖的合成(图5b)。此外,HHQ浓度的降低缓解了铜绿假单胞菌的密度依赖性限制,从而增强其代谢活性。通过这些物质交换,微生物群落的铝耐受性进一步加强,群体活性也随之提升。

图5 基于HHQ交叉喂养的红城红球菌和铜绿假单胞菌协同共存机制以增强铝耐受性。
a. 在单菌培养中,具有较强铝耐受性的铜绿假单胞菌通过群体感应分子HHQ的产生和调控,受密度依赖性限制。相反,红城红球菌单菌培养在Al3+存在下受到抑制,导致细胞壁损伤。然而,当红城红球菌与铜绿假单胞菌共培养时,由铜绿假单胞菌释放的HHQ被红城红球菌吸收。此过程缓解了铜绿假单胞菌的自我限制性生长,增强了物种间的相互作用,并提升了群体对Al3+毒性的耐受性。
b .铜绿假单胞菌在转录因子MvfR的调控下合成HHQ,进而通过群体感应导致自我限制。红城红球菌可通过激活自身QsdR转录因子的表达,启动下游氧化酶(AqdA1B1C1)的合成进而代谢HHQ。在这一过程中,HHQ被裂解和氧化生成邻氨基苯甲酸(AA),随后在色氨酸合成酶(TrpDF)的作用下转化为色氨酸。色氨酸随后调控PGAM和UAGCVT基因的表达,这些基因参与红城红球菌中N-乙酰氨基葡萄糖(GlcNAc)和乙酰胞壁酸(MurNac)的合成,进一步激活DacD和MltG调控基因,促进脂质I和II的合成,从而促进细胞壁的生物合成。
色氨酸作为一种必需氨基酸,在微生物生理中具有重要作用,参与胞壁酸和肽聚糖等细胞壁成分的合成(图4)。色氨酸的可利用性显著影响了红城红球菌的稳定性和功能,表明理解这种代谢依赖性对群落设计具有重要意义。然而,在单菌培养和共培养条件下均未检测到色氨酸,这表明色氨酸不太可能是酸铝逆境下微生物间直接交换的主要交叉喂养代谢物。这一缺失可能是因为在次优环境压力下,微生物的策略偏向于抗胁迫特性的维持,而非资源获取和生长,从而改变了与其他微生物共享的代谢物组成。主导物种往往会将资源集中用于增强抗逆性,而非共享氨基酸等内源性代谢物。因此,对于高铝耐受性微生物来说,在铝毒性环境中,氨基酸成为维持正常细胞壁形态的竞争性营养物,这在铜绿假单胞菌的细胞壁增厚现象中得到了验证。我们发现,喹诺酮化合物介导的交叉喂养机制有助于低铝耐受性微生物在铝胁迫下的生存表现。这些结果突显了微生物在环境胁迫下资源分配和代谢适应的复杂性,为理解微生物生态动力学提供了新的视角。
在农业土壤中设计和优化SynCom以增强植物健康和生长的过程中,关键挑战在于确保引入的微生物菌株能够在土著微生物网络中稳定存活。已有研究表明,本土微生物在克服这一挑战中起到重要作用,因此微生物间的相互作用成为实现合成菌群预期效果的关键因素。例如,本研究表明,SynCom对植物生长的促进效果显著优于单一菌株接种。这种提升源于铜绿假单胞菌和红城红球菌丰度和代谢活性的增加(图1a和d)。铜绿假单胞菌通过群体感应机制产生抗生素促进其定殖,而红城红球菌则降解HHQ,从而在酸性土壤中实现协同共生。基于这些微生物相互作用设计的SynCom还表现出更高的保护性代谢产物生成和更长的群落寿命。因此,利用自然环境中的交叉喂养和群体感应系统,有助于设计在生产力、资源分配和利用、代谢复杂性以及抗入侵性方面优于单一菌株的微生物共生体。
综上所述,本研究揭示了红城红球菌通过利用铜绿假单胞菌分泌的喹诺酮类代谢物来增强其代谢活性。色氨酸生成的增加进一步调控了肽聚糖合成途径,从而增强细胞壁强度,提高铝耐受性。此外,红城红球菌对这些化合物的高效降解缓解了群体感应对铜绿假单胞菌种群的密度依赖性限制。本研究为微生物在严酷环境下自然形成互惠关系的趋势提供了实证支持,尤其是在酸性铝毒性土壤等环境中。通过解读红城红球菌与铜绿假单胞菌之间的代谢对话,为未来提升自然及工程系统中微生物适应性和抗逆性的创新策略奠定了基础。
参考文献
Ma, Z., Jiang, M., Liu, C. et al. Quinolone-mediated metabolic cross-feeding develops aluminium tolerance in soil microbial consortia. Nat Commun15, 10148 (2024). https://doi.org/10.1038/s41467-024-54616-0