生物钟控制了代谢、进食-禁食周期以及睡眠-觉醒活动的日常波动,并在衰老和各种代谢疾病中发挥关键作用。果蝇是研究昼夜节律调节的关键模式生物,已通过遗传筛选鉴定出了大量具有特征的时钟基因。鞘磷脂(SM;在果蝇中为神经酰胺磷酸乙醇胺,CPE)是形成动物细胞质膜的主要鞘脂成分之一,并且普遍分布在所有组织中,特别在中枢神经系统中含量丰富。我们前期脂质组学工作发现个体血浆中鞘磷脂生物节律存在巨大差异,但迄今为止尚不清楚鞘磷脂与昼夜节律调节之间的机制联系。
中国科学院遗传与发育生物学研究所税光厚研究组利用果蝇为模型,通过遗传筛选、脂质/代谢组学、蛋白质组学等系统研究,探究并证实了果蝇神经胶质细胞中鞘磷脂含量在调节果蝇生物节律和寿命中的作用,研究成果以“Endogenous ceramide phosphoethanolamine modulates circadian rhythm via neural-glial coupling in Drosophila”于2022年7月27日在线发表于在National Science Review杂志(DOI:10.1093/nsr/nwac148)。
研究人员首先通过CRISPR/Cas9构建与果蝇CPE生物合成和代谢有关的各种基因突变体并结合基因操纵表达,明确了CPE会影响昼夜节律的维持,发现CPE缺乏会导致节律失常并缩短寿命,而增加CPE则恢复果蝇节律并大大延长其寿命。组织特异性研究发现,星形胶质细胞样神经胶质细胞(ALG)的CPE水平降低是cpes突变体昼夜节律紊乱的基础。神经胶质细胞中的cpes敲降改变了节律基因的分子振荡,cpes1突变体的节律失常和受损的神经胶质表型取决于CPES的催化活性。脂质组学分析表明CPE(而非神经酰胺)的质膜耗竭是节律失常的基础。进一步蛋白质组学分析发现,由Na+/Ka+依赖性兴奋性氨基酸转运体EAAT1介导的谷氨酸兴奋毒性对cpes-RNAi果蝇节律具有潜在作用。cpes敲除果蝇的大脑存在氧化应激升高、线粒体电子传递链功能受损以及通过内肽酶作用导致的蛋白质水解升高。线粒体应激和氧化还原失衡是谷氨酸兴奋毒性的特征。胶质细胞谷氨酸转运体EAAT1的活性可能是通过调节细胞外突触环境协调果蝇昼夜活动节律的基础,该转运体通过将谷氨酸从突触间隙的摄取和清除与Na+/Ka+ATP酶泵(Nrv2)的作用结合起来。
代谢组学研究显示,胶质细胞特异性敲降CPE果蝇大脑中发现大量嘌呤(如腺苷)和氨基酸代谢相关物质(如犬尿氨酸)显著增加,细胞外嘌呤释放可能有助于调节谷氨酸突触前释放,而犬尿氨酸作为谷氨酸拮抗剂,其增加可能意味着代偿性反应,以防止谷氨酸诱导的兴奋性毒性损伤。最后,通过广泛的遗传筛选发现果蝇节律异常活动的跨突触调节失调主要归因于异常的谷氨酸信号和谷氨酸消耗的改变,CPE的减少导致异常的神经胶质谷氨酸信号传导并破坏了昼夜节律,该信号依赖于CPE的内源丰度,在cpes1突变背景下的节律失常运动可以通过表达各自的合酶来恢复内源性鞘磷脂(CPE或SM)来挽救。
综上所述,该研究指出质膜鞘磷脂在调节果蝇昼夜行为中起着至关重要的作用,主要通过神经胶质细胞偶联调节突触谷氨酸稳态,膜脂的功能性区域特异性升高有利于昼夜节律调节和延长寿命。
税光厚研究组博士研究生陈秀鹏和李婕为论文共同第一作者,税光厚研究员和Lam Sin Man博士为本文共同通讯作者。该研究得到了国家自然科学基金和科技部重点研发计划的资助。
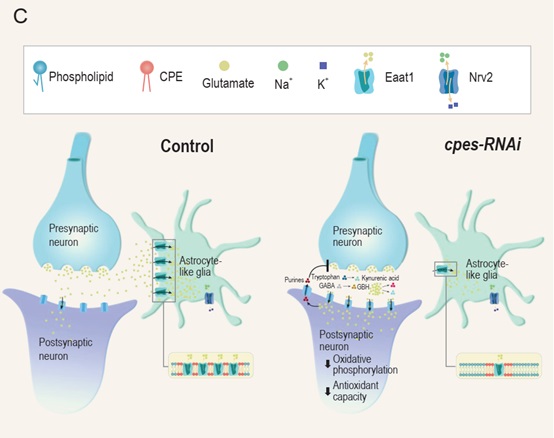
图:神经胶质特异性cpes敲除下异常突触前谷氨酸信号传导的示意图模型